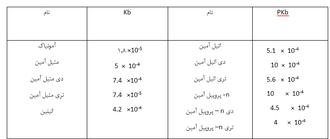
آخرین الکترون
وارد شده در عناصر واسطه بلوک d دراوربیتال d وارد می شود. اما بیرونی
ترین الکترون در اوربیتال s لایه آخر است.
بنابرین در طرح سوالات مربوط به آرایش الکترونی و اعداد
کوانتومی یک الکترون باید دقیقا مشخص شود اخرین الکترون وارد شده یا اولین
الکترونی که جدا می شود کدام منظور است .
در عناصر واسطه قبل از اینکه الکترون در اوربیتال d وارد شود دو
الکترون به تراز S بالایی وارد شده است یعنی تا قبل از ورود الکترون به تراز d سطح انرژی
اوربیتال S پایین تر است اما وقتی اوربیتال d الکترون در یافت کرد کم کم سطح تراز های S وP به هم نزدیک میشه و در
نهایت d سطح انرژی
پایین تری می گیرد.
هنگام واکنش های
شیمیایی ویا یونیزه شدن اتم الکترون از بالاترین سطح اصلی یعنی عدد کوانتومی n بزرگتر جدا می شود.
در اتم های واسطه منظور از آخرین الکترون اتم همان الکترون
تراز s بیرونی است که در یونش اول جدا می شود.
از این رو پیشنهاد می شود برای ترتیب شماره الکترون
ها سطح انرژی انها را از اخر به اول شماره گذاری کنید مثلا وقتی گفته می شود الکترون
26 اتم برم کدام است چنین می نویسیم
1s2,
2s2 ,2p6,3s2 ,3p6, 3d10
4s2 ,4p5
حالا اگر از اول بشماریم 26 تا از الکترونها را به ترتیب می
شمریم و یا اگر از آخر 9 الکترون را جدا کنیم به الکترون 26 میرسیم که الکترون 3d8 بدست می آید
پس توجه کنید باید الکترونها را به ترتیب سطح انرژی و آنهم
لایه های اصلی ردیف کنیم.
خرین الکترون اتم باید بالاترین
سطح انرژی الکترون مد نظر باشد
کروم و منگنز هر دودارای آرایش3d5 هستند آیا اخرین الکترونی که به این
دو اتم وارد میشوند اعداد کوانتومی یکسان دارد؟ الکترون شماره 23 این دو اتم کدام
است؟
در هردو مورد الکترون 23 در اوربیتال 3d5 است. )اخرین الکترون اوربیتال d )