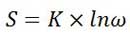پرتو گاما و بتا بدون انحراف از ورقه نازک طلا عبور خواهد کرد. اشعه آلفا مرکب از ذراتی است که هر یک دو پروتون و دو نوترون دارند. این ذرات آلفا با سرعتی حدود 16000 کیلومتر بر ثانیه از اتم رادیواکتیو خارج می شوند و حامل بار الکتریکی +2 و جرمی تقریبا" 4 برابر جرم پروتون هستند. اگر ذرات آلفا از ورقه فلز عبور نمی کرد که رادرفورد نمی توانست از آن برای آزمایش خود استفاده کند. این ذرات از ورقه نازک فلز عبور می کرد. بیشتر آنها بدون انحراف, تعداد کمی با انحراف کمی و تعداد بسیار کمتری از آنها با انحراف بیش از 90 درجه به عقب بازمی گشتند.
اشعه گاما بار نداره وپر نفوذه و عبور می کند واشعه بتا بار منفی داره جذب هسته میشه و سرعت 128000 کیلومتر بر ثانیه دارد در ضمن ضخامت ورقه ها کم بود واز طرف دیگه هسته الومینیم 13 پروتون داره ولی طلا 79 از این رو بتا رد می شود.
در واقع تنها تابش پرتو آلفا به ورقه ی طلا موجب نتیجه گیری درست شده و با تابش بتا وگاما سوالی که در مورد بار مثبت و میزان جرم اون و نتایج حاصل از مدل تامسون توجیه نمی شد شاید انتخاب اشعه الفا وورقه طلا پس از چندین انتخاب مختلف توسط رادرفورد بصورت ازمایش نهایی گزارش شده است. فلز روی نیز در ازمایش رادفورد نوشته است
قطر ورقه ها در نفوذ پذیری آنها در مقابل پرتو موثر است اگر قطر ورقه طلا زیاد بشه ازمایش رادر فورد جواب نمی دهد مانند پرتو گاما از ورقه ضخیم سرب رد نمی شود . رادرفورد در آزمایش خود از فلزات مختلفی استفاده کرد ولی بهترین نتیجه رو با مس و طلا گرفت از دستنوشته رادرفورد می توان گفت یک گلوله توپ به سمت دستمال کاغذی شلیک بشه ولی برگرده این تعجب داره!!